2 Kleine Details Weiner-1990
Wer immer einem anderen Gutes tun will, muß es in kleinen Details
tun... Denn Kunst und Wissenschaft können nur in bis ins
kleinste organisierten Details bestehen. - William Blake
21-32
Meine Glaskugel enthält etwa eine halbe Tasse Luft und zwei Tassen Wasser. In dieser Miniaturatmosphäre und diesem Miniaturozean befindet sich auch eine geringe Menge Kohlendioxid. Und diese Spur Kohlendioxid ist für das Überleben der letzten übriggebliebenen, im Wasser treibenden grünen Pflanzen absolut notwendig.
Jeden Morgen, sobald die Sonne die Öko-Sphäre erreicht, beginnen die Pflanzen (unter anderem) Kohlendioxid aus der Luft und dem Wasser einzuatmen. Molekül für Molekül brechen sie das Kohlendioxid auseinander. Die Kohlenstoffatome behalten sie, die Sauerstoffatome befördern sie wieder hinaus. Als Ergebnis sinkt die Menge des Kohlendioxids in Wasser und Luft, und der Sauerstoffanteil nimmt zu.
Bei Sonnenuntergang oder immer, wenn ich die Lichter in meinem Arbeitszimmer lösche, hören die Pflanzen auf, Kohlendioxid einzuatmen. Nach und nach geben die Lebewesen in der Sphäre den geborgten Kohlenstoff wieder ab. In einem langen und langsamen Ausatmen erstattet das Leben der Luft und dem Wasser den Kohlenstoff zurück. Jede Nacht, bei Dunkelheit, steigt der Gehalt an Kohlendioxid an, während der Sauerstoffgehalt in der Sphäre abnimmt.
Luft und Wasser sind voll von solchen unsichtbaren Zyklen. Die wichtigsten Elemente des Lebens sind — neben Kohlenstoff und Sauerstoff — Wasserstoff, Stickstoff, Phosphor und Schwefel. Jedes dieser Elemente zirkuliert beständig durch die Glaskugel. Und jeder Zyklus ist mit den übrigen verknüpft, so wie Kohlenstoff und Sauerstoff verknüpft sind. Diese Zyklen finden nicht nur innerhalb der Öko-Sphäre statt, sondern überall um uns herum, Tag und Nacht. Da wir sie nicht sehen, scheinen sie uns nicht wichtig zu sein, aber wir brauchen sie so nötig wie unser eigenes Atmen.
Das Studium dieser unsichtbaren Zusammenhänge heißt Geochemie. Geochemiker untersuchen alle sieben Sphären, Erde, Wasser, Luft, Feuer, Leben, Eis und Geist, und daneben die Gesamtheit der Materie und Energie, die in jedem Augenblick von einer Sphäre in die andere gelangt. Sie analysieren so unterschiedliche Dinge wie Lava, Schlamm, Feuer und Sternenlicht, Pflanzendecken, Kuhdung, Saphire und Termitenatem. Geochemiker untersuchen auch die Art und Weise, in der alle diese Substanzen aufeinander reagieren. Sie betrachten ein kompliziertes unsichtbares chemisches Gewebe, das alle Dinge verknüpf, chemische Substanzen, die von jeder der Sphären ausgehen, Dämpfe und Ströme zwischen Erde, Meer und Himmel, die diese Substanzen transportieren und untereinander mischen. Es gibt Hinweise auf »geheime Gesellschaften« von Elementen, auf riesige, alles verbindende Systeme, auf eine planetare Physiologie.
Geochemiker stellen auch unbequeme Fragen nach der Gesundheit des Planeten. Steht das Leben hart an einer Streßschwelle? Wie arbeiten die sieben Sphären zusammen, um den Planeten bewohnbar zu erhalten? Wie sind die Aussichten der Menschen für die nächsten hundert Jahre?
Wenn diese Fragen heute immer vernehmlicher gestellt werden, ist das auch der hartnäckigen Forschung Charles David Keelings zu verdanken.
wikipedia Charles_David_Keeling *1928 in Pennsylvania bis 2005
Keeling begann sein Lebenswerk als junger Mann mit einer einfachen Untersuchung von in Glasflaschen eingeschlossener Luft. Dieser erste Blick führte rasch zu einer Sicht, die die Welt veränderte. Keeling konzentrierte seine Forschungstätigkeit von nun an darauf, dieselben Messungen in genau derselben Weise und mit exakt denselben Instrumenten immer aufs neue zu wiederholen. Heute stellt diese sich noch immer verlängernde Aufzeichnung, Keelings Kurve, so etwas wie einen Zeitraffer-Röntgenfilm vom Funktionieren der Sphären, eine Innenansicht des Stoffwechsels unseres Planeten dar.
*
1954 machte Keeling seinen Doktor in Chemie an der Northwestern University in Evanston, Illinois. Er war sechsundzwanzig Jahre alt. Von zehn seiner Klassenkameraden nahmen neun Stellen in der chemischen Industrie an, wo sie nach Keelings Worten dafür bezahlt werden, daß sie »Frühstücksflocken knuspriger, Motoröl ergiebiger, Kunststoffe billiger und Antibiotika teurer machen«.
22
Keeling hatte in seiner Collegezeit das Campen und Wandern entdeckt. Er wollte seinem Beruf in freier Natur nachgehen, wo der Horizont weiter als der Meniskus eines Teströhrchens reicht. Obwohl er Doktor der Chemie war, schickte er ungestüme Bewerbungsbriefe an die Dekane von zehn Geologieabteilungen verschiedener Universitäten.
Wie es der Zufall wollte, hatte das California Institute of Technology in Pasadena gerade ein Geochemieprogramm gestartet. Das war etwas Neues; die Chemie der Erde war bislang kein gesondert behandelter Gegenstand gewesen. Harrison Brown, der Leiter der neuen Abteilung, stellte Keeling ein.
Bald nachdem Keeling seine Arbeit am Institut aufgenommen hatte, hörte er Brown eine unbesonnene Bemerkung machen. Brown war mitten in einer zwanglosen Plauderei mit einer kleinen Gruppe seiner Geochemiker. Er beschrieb die natürliche Säure von Seen und Flüssen und sagte dabei auch etwas über Bikarbonat im Wasser. Seine Hypothese setzte, wie Keeling bemerkte, voraus, daß sich das in Wasser gelöste Kohlendioxid immer im Gleichgewicht mit dem Kohlendioxid in der Luft über dem Wasser befindet.
Das forderte Keeling heraus. Er wies Brown auf die Möglichkeit hin, daß ein Ungleichgewicht zwischen dem Gas im Wasser und dem in der Luft bestehen könne. Er hatte noch nicht viel über diesen Gegenstand nachgedacht (sagt er jetzt), und seine These war in einem geschlossenen Raum nicht nachprüfbar. »Also sagte ich zu Harrison Brown: <Ich würde gern ein Experiment machen, um zu sehen, ob Sie recht haben.>«
Mit dem Segen seines Chefs ging Keeling ans Werk, die Sache zu überprüfen, und plante ein einfaches Experiment. Er wollte den Kohlendioxidanteil in einem Fluß und in der Luft über diesem Fluß messen und so herausfinden, ob der Gasdruck in beiden Medien gleich war. Zu diesem Zweck brauchte er ein Gerät, das den Kohlendioxidanteil in der Luft und im Wasser in kleinen Quantitäten, in Teilen pro Million messen konnte. Ein solches Instrument gab es auf dem Markt aber noch nicht, und Keeling fand in der wissenschaftlichen Literatur keine Anweisung, wie man es bauen konnte. Nach einigem Suchen fand er einen alten Artikel aus dem Jahre 1916, in dem ein Manometer — ein Instrument zur Messung kleiner Gasquantitäten — beschrieben wurde. Nach geringfügigen Verbesserungen mochte es für seine Absicht ausreichen.
23
Der erste Forscher, der Kohlendioxidmessungen vornahm, war zugleich der erste, der entdeckte, daß die Luft, die wir atmen, keine einzelne Substanz, sondern eine Mischung verschiedener Substanzen ist. Es war der flämische Alchimist und Physiker Johann Baptista van Helmont.
wikipedia Johan_Baptista_van_Helmont *1580 in Brüssel
In einem nach seinem Tod 1644 veröffentlichten Manuskript folgerte er aus direkten und indirekten Indizien, daß ein unsichtbarer »Spiritus« sowohl allen aufwallenden Flüssigkeiten in den Phiolen als auch der glühenden Holzkohle in seinem alchimistischen Labor entwich. »Ich benenne diesen bisher nicht bekannten Spiritus mit dem neuen Namen Gas«, schrieb er — ein Wort, das er nach der flämischen Aussprache des griechischen Wortes chaos geprägt hatte.
Das Hauptinteresse van Helmonts galt dem Kohlendioxid. Er nannte es gas silvestris, Spiritus des Holzes, weil es brennenden Scheiten und Holzkohlen entwich. Obwohl er als Alchimist in der langen Tradition mittelalterlicher Magie stand, konnte er den Wert genauer Messungen bereits würdigen; eine der Einsichten, die dazu beitrugen, die Methoden der schwarzen Magie in moderne Wissenschaft zu transformieren. Unter anderem versuchte van Helmont zu messen, wieviel Gas er der Luft hinzufügte, indem er Holzkohle in einem Ofen verbrannte. Als er »zweiundsechzig Pfund eichene Holzkohle« verbrannt hatte und die Asche wog, war nur noch ein Pfund übriggeblieben. »Deshalb«, so schrieb er, »sind einundsechzig Pfund der wilde Spiritus.«
Ein Jahrhundert danach suchte der Medizinstudent Joseph Black nach einer Behandlung von Nierensteinen. Die bekannteste Arznei gegen diese »Steine« enthielt unter anderem Kreide, eine weißliche Substanz, die durch »Brennen« von Kalkstein oder Eierschalen entsteht. In Wasser gelöst, ergibt Kreide einen milden, hellen Trank.
Black experimentierte mit Kalkwasser und einigen anderen Substanzen, und am 3. Januar 1754 — er war damals sechsundzwanzig Jahre alt — schrieb er seinem Professor an der Edinburgher Universität einen begeisterten Brief. Dieser beginnt mit einer flüchtigen Rechtfertigung:
»Ich hatte die feste Absicht, schon mit der letzten Post zu schreiben, aber wie es sich ergab, hatte ich zu der betreffenden Zeit etwas anderes im Sinn und vergaß den Brief. Es war ein Experiment, das mich gefangennahm...«
Am Abend zuvor hatte Black ein Stück Kreide in ein hohes Glas fallen lassen und Säure darüber gegossen. Die Kreide hatte heftig gezischt. Dann war die Flamme der Kerze neben dem Glas wie von Geisterhand ausgelöscht worden.
24
Black, der van Helmonts Schriften gelesen hatte, fragte sich, ob vielleicht ein von der zischenden Kreide entweichendes Gas die Kerze gelöscht hatte. Er nahm ein Stück Papier, zündete es an einer Ecke an und senkte die brennende Ecke langsam in das Glas. Die Flamme erlosch, »als hätte ich sie in Wasser getaucht«.
Black hatte das Kohlendioxid wiederentdeckt. Bald fand er heraus, daß Kalkwasser einen guten Kohlendioxiddetektor abgibt. Setzte er ein Glas voll Kalkwasser einer starken Kohlendioxidquelle aus, wie etwa einer Kreide-Säure-Reaktion oder im Kamin brennenden Holzklötzen, begann sich der im Wasser gelöste Kalk wie Schnee am Boden des Gefäßes abzusetzen. Je mehr Gas, desto mehr Schnee.
Bei seiner Arbeit mit dem Detektor fand Black fast überall Kohlendioxid vor. Es steigt in Blasen im Mineralwasser auf, wie etwa in der berühmten Quelle von Perrier. Es entweicht Fässern voll Fermentierhefe. Es sickert aus Minenwänden. Es entströmt in beachtlichen Mengen fast allem, was brennt — Holz, Papier, Kohlen, Öl, Kalkstein, Gummi oder Apfelstückchen.
Eines Tages tauchte Black einen Strohhalm in ein Gefäß mit Kalkwasser und blies hinein. Dann lehnte er sich zurück und sah dem von ihm verursachten Schneesturm zu. Menschlicher Atem ist voller Kohlendioxid.
Kohlendioxid wurde eine der interessantesten Substanzen in der Wissenschaft, besonders nachdem Priestley, Lavoisier und andere festgestellt hatten, daß dieses Gas von allen Tieren ausgeatmet und von allen grünen Pflanzen eingeatmet wird. Es schien eine unendliche Vielzahl von Quellen zu haben, obwohl es in der Atmosphäre nur in sehr geringen Mengen vorkam. Unter denen, die es zu messen versuchten, waren der deutsche Naturforscher und Weltreisende Alexander von Humboldt, der französische Chemiker Louis Joseph Gay-Lussac und die Schweizer Geologen Horace Benedict und Nicolas Theodore de Saussure*. Gay-Lussac nahm beim ersten Aufstieg eines Heißluftballons in große Höhe ein Gefäß mit Kalkwasser mit. Und dasselbe tat de Saussure d.Ä., oft als Vater der Bergsteigerei bezeichnet, bei seiner ersten Besteigung des Montblanc.
Der genaue Anteil des Kohlendioxides in der Atmosphäre erwies sich als schwer meßbar. Er war nicht nur gering, sondern schwankte auch von Probe zu Probe. Der Mittelwert lag bei etwa drei Hundertstel eines Prozents.
* Gay-Lussac, Louis Joseph, 1778-1850, legte zusammen mit Thenard das Fundament für die organische Elementaranalyse. Saussure, Horace Benedict de, 1740-1799, Schweizer Naturforscher, bestieg 1787 als zweiter den Montblanc. Saussure, Nicolas Theodore de, 1767-1845, dessen Sohn, verfaßte Arbeiten über Pflanzenphysiologie. (Anm. d. Übers.)
25
Im späten 19. Jahrhundert war Jean Reiset einer der vielen Forscher, die das Kohlendioxid faszinierte. Reiset befestigte ein riesiges Wasserfaß auf einem Pferdewagen und kutschierte damit bei Tag und Nacht, sommers wie winters, durch die Straßen von Paris und auf den Landwegen des an der Nordwestküste Frankreichs gelegenen Dörfchens Ecorcheboeuf. Wenn er eine Luftprobe nehmen wollte, hieß er die Pferde anhalten und entstöpselte das Faß. Etliche hundert Liter Wasser liefen aus, und die gleiche Menge Luft wurde hineingesogen. Auf ihrem Weg durch die Meßapparatur wurde die Luft dann durch mehr Kammern gesogen, als eine Kuh Mägen hat, und in jeder Kammer setzte sie kleine Wirbelstürme frei.
Reiset stellte fest, daß die Luft in Paris viel mehr Kohlendioxid enthielt als die Luft auf dem Land; eine Tatsache, die er auf die qualmenden Kamine der Stadthäuser und die Rauchfahnen der Pariser Fabrikschlote zurückführte. (»Die Kamine«, schrieb er, »stoßen bei Tag und Nacht Ströme von Kohlendioxid aus.«) Die im späten 19. Jahrhundert gemessenen Werte wiesen große Schwankungen auf, aber sie bewegten sich immer noch um drei Hundertstel eines Prozents oder dreihundert Teile pro Million.
Zwanzig Jahre nach Reiset kam das Messen des Kohlendioxids aus der Mode. In der ersten Hälfte des 20. Jahrhunderts war einer der wenigen, die es versuchten, ein Schwede namens Kurt Buch. Er berichtete, daß sein Anteil in der Luft stark variierte, von Ort zu Ort, von Breitengrad zu Breitengrad und abhängig von den Windverhältnissen. Er erhielt einen niedrigsten Wert von weniger als hundertfünfzig Teilen pro Million und einen Höchstwert von mehr als dreihundertfünfzig Teilen. Der Durchschnitt lag wieder bei ungefähr drei Hundertstel eines Prozents.
*
Keeling war im Herbst 1953 an das California Institute of Technology gekommen. Die folgenden Monate verbrachte er damit, das Manometer umzukonstruieren und Methoden zu entwickeln, mit deren Hilfe er Kohlendioxid aus Luft und Wasser entnehmen konnte, um geeignete Proben für sein Manometer zu erhalten. Er war auf sich selbst gestellt. Brown hielt sich nur wenig im Institut auf, wie sich Keeling erinnert, denn er schrieb zu jener Zeit ein Buch. Brown schätzte es ohnehin, seine Leute tun zu lassen, was sie wollten. Während seiner Abwesenheit meinte ein älterer Kollege, Keeling solle sein Projekt doch mit bereits im Labor vorhandenen Geräten ausführen; es sei wirklich nicht nötig, daß er ein Manometer baue.
26
Aber Keeling besitzt ein gerüttelt Maß Eigensinn, sobald es um mehr als einige hundert Teile pro Million geht. »Es gab keinen besonderen Grund«, sagt er, »aus dem ich mir vorgenommen hätte, das Gerät so genau wie nur möglich zu konstruieren.« Tatsächlich machte er das Gerät »etwa zehnmal genauer, als notwendig gewesen wäre«.
Er werkelte noch immer daran herum, als Brown in sein Labor geschlendert kam und ihn mit einem Belegexemplar seines Buches beschenkte. Keeling bewahrt es noch heute in seinem Büro auf. Vor kurzem nahm er es auf meine Bitte hin aus dem Regal, holte seine silbergefaßte Lesebrille hervor und schlug die Titelseite auf. Die Widmung lautet:
Für Dave Keeling (der weiß, was er tut),
Mit den besten Wünschen für die Zukunft.
Herzlich
Harrison Brown
April 1954»Hmm«, sagte Keeling, »April 1954. Das war allerdings bevor ich wußte, was ich tat. In Wirklichkeit wollte er sagen, daß ich zu störrisch war, um Vorschläge anzunehmen.«
Brown verließ die Stadt, und Keeling kehrte zu seiner Glasbläserei zurück. Aber Browns Stellvertreter begannen sich unwohl zu fühlen. Keelings Anstellung galt nur für ein Jahr, obwohl sie auf drei Jahre verlängert werden konnte. »Sie wollten einen Beweis dafür, daß ich etwas tat, und im September 1954, als mein erstes Jahr vorbei war, hatte ich verdammt wenig vorzuweisen.«
In einer Hinsicht aber war das Jahr produktiv gewesen: Keeling hatte inzwischen geheiratet. Browns Vertreter beschlossen: »Nun, wir können diesen Burschen nicht einfach hinausschmeißen. Er hat eine schwangere Frau und keinen Job.« Und sie verlängerten seinen Vertrag.
*
Im Frühling 1955 - er arbeitete jetzt fieberhaft - stellte Keeling sein Manometer fertig. Er hatte zwölf Monate mit Vorbereitungen zugebracht. In Anbetracht des ungeduldigen Fingertrommelns seiner Vorgesetzten und angesichts der Tatsache, daß sein erstes Kind in zwei Wochen erwartet wurde, hätte man glauben müssen, daß er schnurstracks auf das nächste Feld und zum nächsten Fluß laufen und sein Gerät ausprobieren würde.
Aber Keeling übertrieb es wieder einmal.
Eines schönen Morgens im März trat er aus seinem Penthouselabor und erschien auf dem Dach, in der Hand eine Glasflasche von etwa dreißig Zentimetern Durchmesser. Er hatte im Labor die Luft aus ihr gezogen.
27
Nun öffnete er den Absperrhahn der Flasche, hielt den Atem an und trat zurück, damit die in die Flasche strömende Luft nicht durch sein ausgeatmetes Kohlendioxid verunreinigt wurde. Dann eilte er wieder zur Flasche, schloß den Sperrhahn und begab sich mit ihr ins Labor zurück. Sie sah natürlich ebenso leer aus wie zuvor.
Keeling isolierte das Kohlendioxid in der Flasche mit Hilfe von flüssigem Stickstoff. Anschließend gab er das Kohlendioxid in eine der Kammern seines neuen Manometers und komprimierte es mittels einer hohen schimmernden Quecksilbersäule. Die in der Flasche befindliche Luft enthielt dreihundertfünfzig Teile pro Million.
Etwas bestimmte Keeling, den Versuch zu wiederholen — nicht nur einmal. Während der nächsten vierundzwanzig Stunden begab er sich alle vier Stunden aufs Dach und zeichnete die Resultate jeder einzelnen Messung in einem kleinen grünen Notizbuch auf. Dann begann er mit einer neuen Versuchsfolge rund um die Uhr.
Er war mitten beim dritten Vierundzwanzigstundentest, als bei seiner Frau die Wehen begannen. Er brachte sie ins Krankenhaus, lief im Wartezimmer hin und her und behielt die Uhr im Auge. Alle vier Stunden eilte er zum Labordach zurück. (»Der Ehemann«, sagte er, »kann ja schließlich kaum etwas tun.«) Als sein Sohn Drew geboren wurde, war Keeling im Labor.
Während der nächsten Wochen stand Keeling immer wieder mitten in der Nacht auf, um Luftproben zu nehmen. Dann packten sie Gasflaschen in einen Karton, nahmen das Baby und fuhren in die Natur. Den 18. und 19. Mai 1955 verbrachten sie am Big Sur River, umgeben von Küstenmammutbäumen, und füllten neun Flaschen mit Luft. Am 2. und 3. Juni füllten sie Flaschen an einem Fluß im Yosemite National Park. Im Juli waren sie in den Inyo Mountains, im August in den Cascade Mountains und im September im Olympic National Park.
*
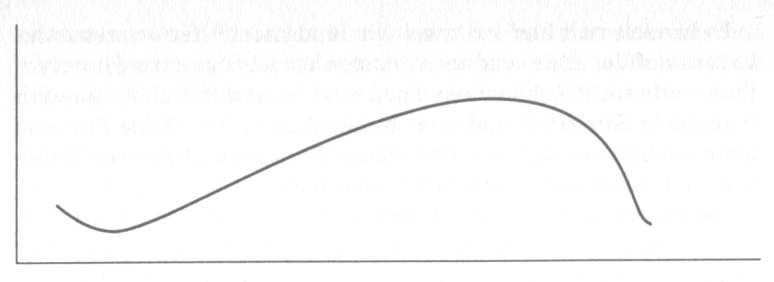
Als Keeling wieder in seinem Labor war, maß er das Kohlendioxid in seinen Proben und brütete über dem Notizbuchinhalt. Er entdeckte eine Regelmäßigkeit. Die Kohlendioxidkonzentration nahm immer dann zu, wenn die Sonne unterging. Sie blieb die ganze Nacht über bis in den Morgen hinein hoch. Gegen Mittag sank sie ab, erreichte ihren Tiefpunkt am Nachmittag und begann nach Sonnenuntergang wieder zu steigen. Keeling hielt diesen Verlauf auf Millimeterpapier fest.
Für den Yosemite Park sah die Graphik ungefähr so aus:
28/29

Diese Linie stellt eine Übersicht über den Tagesablauf im Leben der Biosphäre dar. Jeden Tag bei Sonnenaufgang beginnt alles Grün bei der Durchführung der Photosynthese Kohlendioxid einzuatmen, und der Kohlendioxidgehalt der Luft fällt. Photosynthese heißt wörtlich »Aufbau mittels Licht«, und der Aufbauprozeß ist in einem Wald oder in der Kugelschale einer Öko-Sphäre im Prinzip derselbe. Innerhalb der Pflanzenzellen findet er in Organellen namens Chloroplasten statt, die unter dem Mikroskop wie smaragdgrüne Öko-Sphären aussehen.
In jedem Chloroplast spalten die Pflanzen Kohlendioxidmoleküle in Kohlenstoff und Sauerstoff auf. Ebenso spalten sie Wassermoleküle in Wasserstoff und Sauerstoff. Dann setzen sie die meisten dieser Atome neu zusammen und stellen einfache Zucker wie Saccharose her, indem sie einen Teil des Sauerstoffs als Abfall hinausschleudern. Dieser Vorgang erfordert eine ständige Energieversorgung mit Sonnenlicht und die fortwährende Versorgung mit Kohlendioxid und Wasser als Rohmaterialien. Die Photosynthese würde ohne den im Kohlendioxid enthaltenen Kohlenstoff nicht funktionieren. Alle Zucker — und darüber hinaus jedes Molekül in der Biosphäre, einschließlich der DNA-Spirale — werden durch Kohlenstoff zusammengehalten. Kohlenstoffatome hängen sich zu langen Ketten und Ringen zusammen, an die sich andere Elemente anfügen lassen. Sie sind wie die kleinen Verbindungsstücke in Modellbaukästen. Mit ihrer Hilfe kann man fast alles bauen, sogar eine Wendeltreppe; ohne sie würde die Wendeltreppe im Nu einfallen.
Am Nachmittag haben die Pflanzen dem Kreislauf eine Menge Kohlendioxid entnommen. Zugleich verzehren sie eifrig die für den Eigenbedarf produzierten Zucker. Das ist der metabolische Prozeß der Respiration. Respiration heißt wörtlich »Zurückatmung, Zurückblasen«, und sie ist eine Verbrennung, allerdings eine sehr langsame Verbrennung. Sie verbraucht Sauerstoff und produziert Kohlendioxid, wie Holz, das in einem Kamin verbrennt.
29
Es handelt sich hier um zwei der fundamentalsten Prozesse des Lebens auf der Erde, und sie verlaufen entgegengesetzt. Photosynthese verbraucht Kohlendioxid und setzt Sauerstoff frei, Respiration verbraucht Sauerstoff und setzt Kohlendioxid frei. Beide Prozesse laufen außerdem nach verschiedenen Zeitplänen ab; dieser Tatbestand erschließt für Geochemiker eine Welt.
Die Photosynthese vollzieht sich in der Tagesschicht, da sie Sonnenlicht benötigt, und die meisten Pflanzen nehmen nur Kohlendioxid auf, wenn die Sonne scheint. Das Gas tritt durch eine Myriade mikroskopischer Poren ein, Spalten auf der Unterseite aller grünen Blätter. Diese öffnen sich bei Sonnenaufgang und schließen sich nach Sonnenuntergang. Die Respiration vollzieht sich in einer Tagesschicht und in einer Nachtschicht. Um vier Uhr morgens, wenn die Poren noch geschlossen sind und grüne Blätter absolut kein Kohlendioxid aufnehmen, atmen sie trotzdem: Sie blasen Kohlendioxid in die Atmosphäre zurück.
Gegen Ende der Nacht gleichen sich die Konten also mehr oder weniger aus. Das heißt, am Ende einer Vierundzwanzigstundenperiode haben die meisten Pflanzen der Atmosphäre die geborgte Menge Kohlendioxid in etwa wieder zurückerstattet.
Während Keeling mit Kisten voller Gasflaschen durch die Wälder strich und ein- oder zweimal pro Sekunde atmete, hatte auch der Wald geatmet, aber nur einmal am Tag. Tiere fallen bei diesem täglichen Rhythmus nicht sehr ins Gewicht. Sie besitzen keine Chloroplasten, die ja die grünen Hauptakteure der Photosynthese sind. Und bis ein Genetikingenieur eine grüne Kuh konstruiert, werden die Tiere fortfahren, all ihre Energie und Baumaterialien zu beziehen, indem sie Pflanzen fressen und Tiere, die Pflanzen gefressen haben, und indem sie Sauerstoff einatmen, den Pflanzen abgegeben haben. Ihre Rolle im großen Plan ist peripher.
Für Geochemiker macht das alles die Atmosphäre zu einem Fenster der Biosphäre. Wenn Photosynthese und Respiration nach demselben Plan abliefen, wäre das Gasniveau in einem Wald oder in einer Glaskugel immer flach und langweilig, eine gerade Linie, die kaum Information böte. Da diese beiden Prozesse aber nicht synchron ablaufen, nimmt der Betrag an Kohlendioxid in der Atmosphäre ständig zu und ab, und die Atmosphäre ist stets voller Information über die Biosphäre.
Der Blick aus der Luft ist erhaben. Von oben betrachtet verschwinden Menschen, Bäume und Flüsse. Ein Mißklang gegenläufiger Prozesse wie Photosynthese und Respiration löst sich vollständig zu einer einzigen Wellenlinie auf, einem Mittelwert oder der Gesamtheit all dessen, was im Wald wächst, atmet und stirbt. Von diesem kosmischen Ort aus gesehen zählt nicht das Individuum, sondern nur die Masse, die Biosphäre als Ganzes.
30/31
*
Keeling wunderte sich besonders über den Wert, den er für die Luft am Nachmittag erhielt. Dann sank dieser nämlich stets auf seinen niedrigsten Stand, etwa dreihundertfünfzehn Teile pro Million. Weder im Yosemite Nationalpark noch am Big Sur River oder in den Cascade Mountains sank die Konzentration je tiefer als um zwei oder drei Uhr nachmittags.
Den Lehrbüchern zufolge schwankte der Kohlendioxidgehalt aber von Brise zu Brise, von Ort zu Ort; von mehr als dreihundertfünfzehn Teilen pro Million bis weit weniger. Keelings Nachmittagswert hingegen, der tiefste jeden Tages, lag immer etwa bei dreihundertfünfzehn. Das hatte er bisher nirgends gelesen. Wieso nahm der Kohlendioxidgehalt in einem Wald immer bis auf dreihundertfünfzehn Teile ab?
In jenem Winter fuhr Keeling mit einer großen Kiste voller Gasflaschen erneut in die Inyo Mountains im östlichen Kalifornien. Er campierte während eines Wintersturms auf einer hochgelegenen Ebene gegenüber dem Mount Whitney in 3650 Meter Höhe. Alle vier Stunden, bei Tag und Nacht, begab er sich in den Sturm hinaus und kämpfte sich ein paar Meter weit über den Schnee, um eine Flasche zu füllen. Der Wind heulte fünf Tage lang, und Keeling füllte dreißig Flaschen mit der Essenz des Sturms der Pacific Mountains. Dann fuhr er nach Hause zu seinem Manometer.
»Und hier war eine Kohlendioxidkonzentration...«, sagt Keeling heute und beugt sich immer noch erregt in seinem alten Drehsessel über seinen Schreibtisch. »Sie war nicht nur konstant, sondern lag außerdem genau in der Mitte dieser Reihe niedriger Werte. Sie blieb beharrlich bei dreihundertfünfzehn Teilen pro Million.«
Jetzt glaubte Keeling die Zahl dreihundertfünfzehn zu begreifen. Der Sturm in seiner Flasche war Tausende von Meilen über den Pazifik gerast, ehe er die Inyo Mountains heimgesucht hatte. Es war ein von allen lokalen Einflüssen völlig freier Sturm, ein so weitgereister, so kosmopolitischer Sturm, daß er so etwas wie den Durchschnitt aller Luft auf Erden repräsentieren mochte.
Bisher hatten die Forscher ihre Proben einfach an den falschen Orten genommen — in den Straßen von Paris, in Gärten und Wäldern. Wenn man sich aber an die abgelegensten Stellen der Erde begeben mußte, wo die Luft rein ist und all das Durcheinander von Photosynthese und Respiration, Lagerfeuern und Fabrikschloten vereinheitlicht, vermengt und verschmolzen wurde?
Angenommen, der Wind führt so etwas wie den Durchschnitt allen Kohlendioxids des Planeten mit sich. Angenommen, der Betrag an Kohlendioxid in der Erdatmosphäre macht ungefähr dreihundertfünfzehn Teile pro Million aus?
Das würde erklären, weshalb seine, Keelings, Zahlen am Nachmittag immer annähernd den Wert dreihundertfünfzehn erreichten. Ein Wald ist ein Gewirr lokaler Einflüsse. Aber am Nachmittag hat die Sonne den Boden erwärmt und die über ihm befindliche Luft aufsteigen lassen, wie etwa der Auftrieb eines Lagerfeuers den Rauch hochbläst. Wenn die durch den Boden erwärmte Luft nach oben steigt, sinkt von oben her kühlere Luft zu Boden, um sie zu ersetzen. Luftmassen zirkulieren fortwährend über der Landschaft, selbst die Luft in der Mitte eines dichten Waldes an einem anscheinend windstillen Tag wird davon erfaßt.
»So!« sagt Keeling, öffnet eine Schreibtischschublade, holt seine erste Veröffentlichung über diesen Gegenstand heraus, säubert noch einmal seine Brille und deutet auf jene magische Zahl dreihundertfünfzehn.
»Völlig im Gegensatz zu dem, was man damals glaubte, sehen Sie?« sagt er. »Und es basiert auf nur wenigen Messungen — und auf meinem launischen Wunsch nach einem genauen Manometer. Ich habe nicht versucht, das Verfahren zu kopieren, das das Buch in Skandinavien angewandt hatte. Ich habe einfach auf nichts etwas gegeben, oder?«
32
#
The Next One Hundred Years / Die Klimakatastrophe